Idées Chimiques 6,6
Spectroscopie de résonance magnétique nucléaire
(RMN)
Problèmes
pour 6,6
1
Un composé
avec la formule empirique C4H8O a donné le spectre de RMN
montré au-dessous. Le spectre infrarouge
a renforcé la présence d’un groupe C=O.
a
Combien
de sortes de protons existe-il dans le composé ?
Il en existe 3
b
Construisez
une table et faites une liste du changement chimique (δ) et nombre relatif
de protons pour chaque signal dans le spectre.
Changement chimique : 2,4 2,0 1,0
Nombre relatif de
protons : 2 3 3
c
Quelle
sorte de proton produit chaque signal ?
Changement chimique : 2,4 2,0 1,0
Nombre relatif de
protons : 2 3 3
Sorte de proton : A B C
A = ![]() B
=
B
= ![]() C =
C = ![]()
d
Suggérez
une structure pour le composé.
![]()
2
Les
acides suivants sont parmi lesquelles qui sont souvent trouvés dans le vin.
Acide tartrique (T), acide
succinique (S), acide citrique (C)
a
Pour
chaque composé, constatez combien de signaux vous attendriez-vous dans son
spectre de RMN. Expliquez votre raisonnement.
T : 3 signaux – COOH, OH, CH
S : 2 signaux – COOH, CH2
C : 3 signaux – CH2,
b
Donnez
les proportions des zones maximums de chaque composé.
T : COOH
– 2H
OH – 2H
CH – 2H
S : COOH
– 2H
CH2 – 4H
C : CH2
– 4H
COOH – 3H
OH – 1H
3
Le spectre
RMN d’un alcool, E, est montré au-dessous.
a
Identifiez
le changement chimique et nombre relatif de protons pour chaque signal dans le
spectre.
3,8 – 2H
2,6 – 1H
1,2 – 3H
b
Quelle
sorte de proton produit chaque signal ?
Changement chimique : 3,7 2,6 1,2
Nombre relatif de
protons : 2 1 3
Sorte de proton : α β γ
α = –CH2–OH β = R–OH γ
= R–CH3
c
La
masse relative de l’alcool est 46.
Identifiez la molécule.
Je crois que cette molécule
consiste en deux atomes de carbone, un groupe hydroxyle, et six atomes
d’hydrogène.
Proportions – C : H : O – 2 :
6 : 1. CH3-CH2-OH.
À ce qu’il me semble,
l’alcool doit être éthanol.
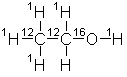
Masse
relative en chiffres = 6 * 1H = 06
2 * 12C = 24
1
* 16O = 16 +
Masse relative totale = 6
+ 24 + 16 = 46
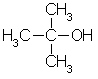
4
Le
spectre de RMN pour un autre alcool, F,
est montré dans la figure 48.
a
Identifiez
le changement chimique et nombre relatif de protons pour chaque signal dans le
spectre, et…
b
…quelle
sorte de proton produit chaque signal ?
Changement chimique : 2,0 1,2
Nombre relatif de
protons : 1 9
Sorte de proton : δ ε
δ = R–OH ε
= R–CH3
La molécule doit être 2-(méthyle)
propan-2-ol